当前位置 :
首页 >
最新资讯 >
实务分析和研究 >
专利
基于“有效保护期”的中国药品专利保护期限补偿制度的效能分析
中国专利代理师 中国律师 王岩
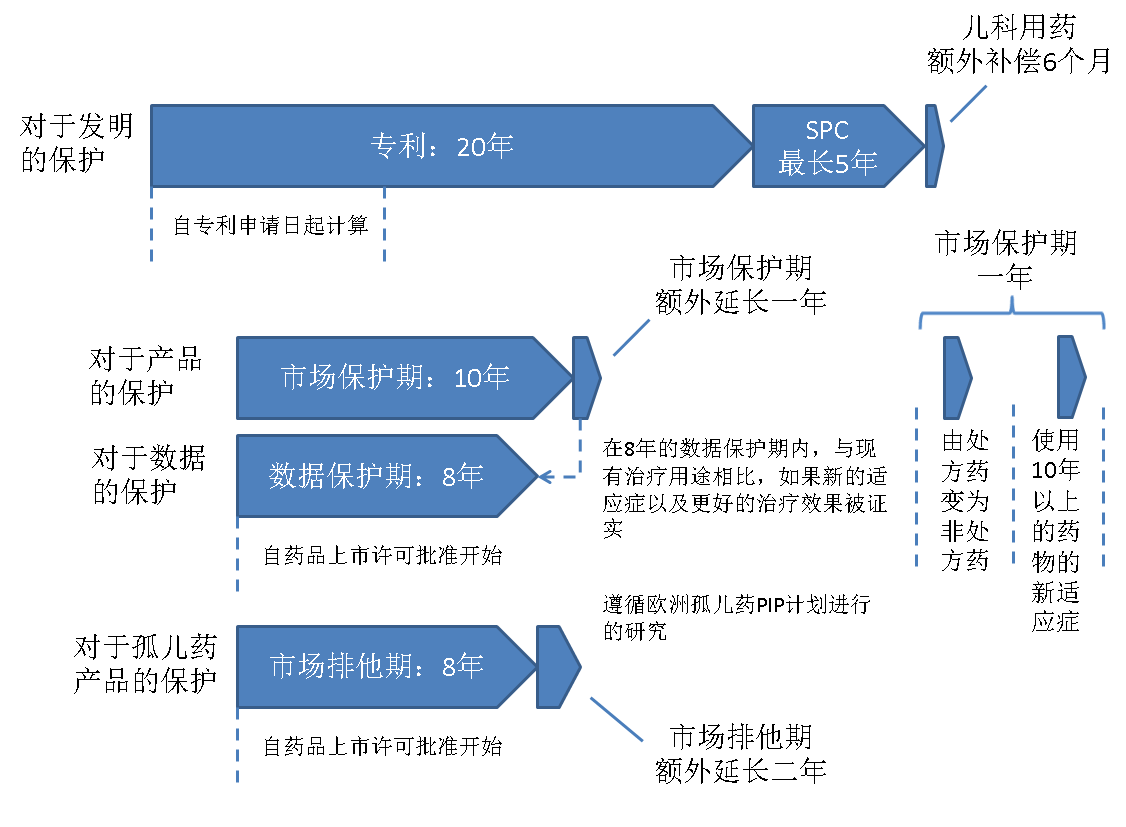
药品专利保护期限补偿制度的由来 “ 有效保护期 ” 的概念 欧洲的 SPC 制度、数据保护期、市场保护期
图1 欧盟给予原研药的保护期示意图
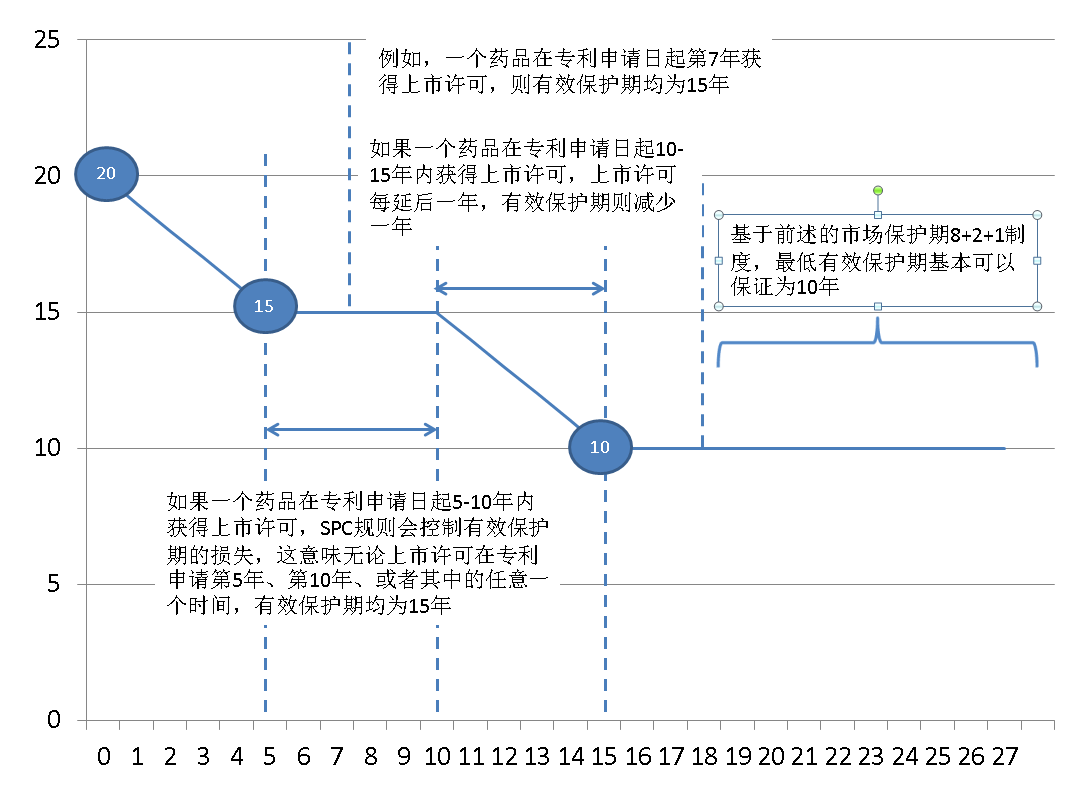
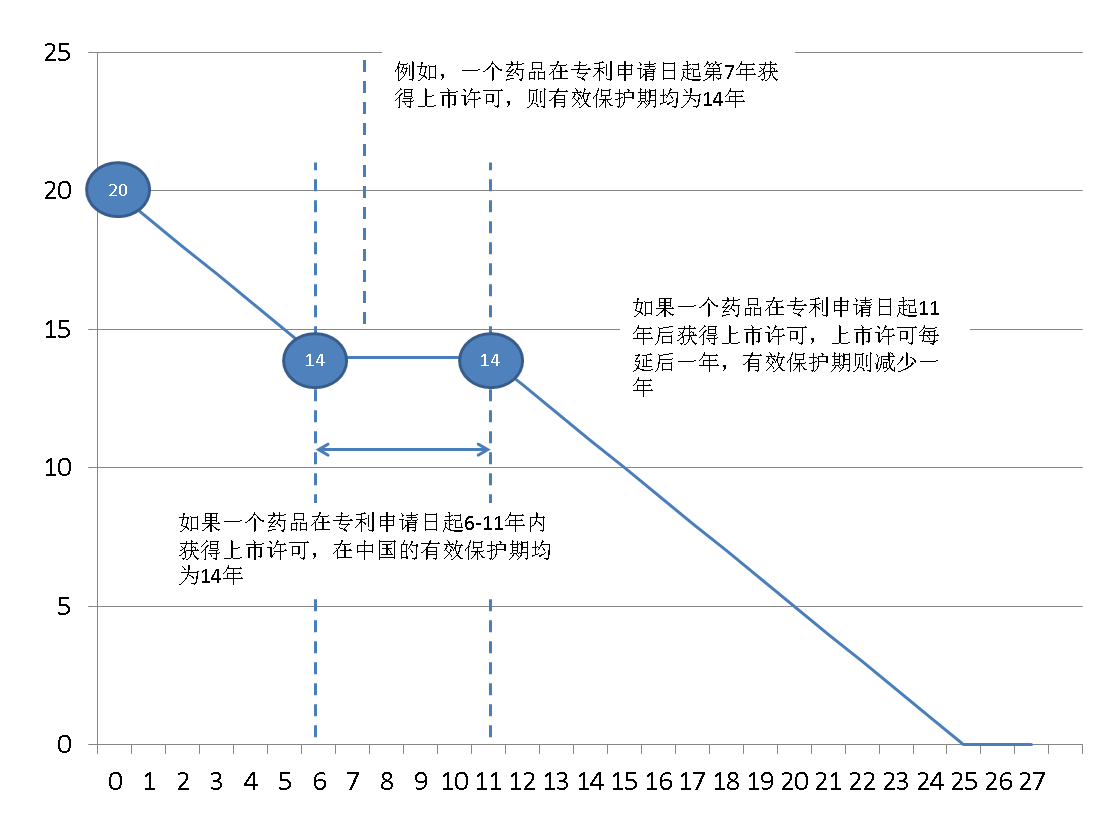
图2 “有效保护期”示意图
具体精算例
Ravatio的活性成分西地那非的专利基于SPC制度,获得了2年的SPC补偿保护期,并于2013年到期,但是Ravatio基于孤儿药所赋予的10年市场排他期,仍然获得了10年的有效保护期。结论
分享页面