「実質保護期間」から見る中国医薬品特許期間の延長制度の効果
中国弁理士・弁護士 王 岩
1 。● PTE制度の由来 (中国における医薬品の販売承認日-特許出願日) -5年● 「実質保護期間」の概念 ● 欧洲のSPC制度、データ保護期間、市場保護期間
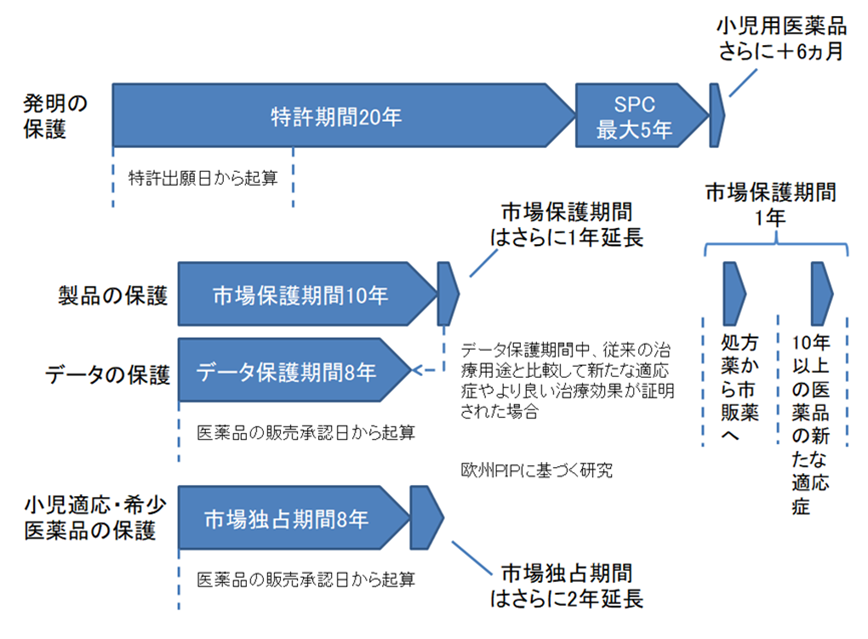
図1 EUにおける先発薬の保護期間の概略図2
EUの制度に基づく医薬品の「実質保護期間」は以下のとおりである。
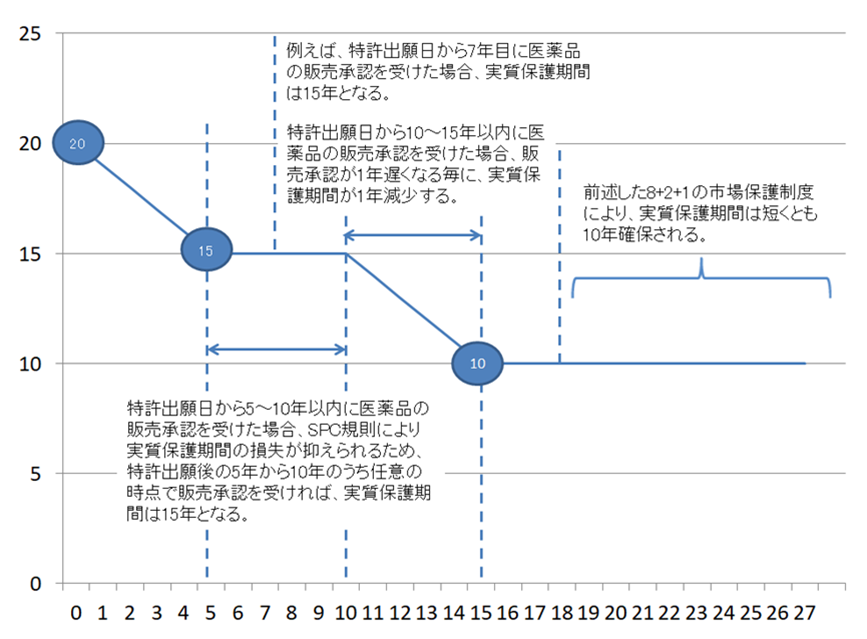
図2 「実質保護期間」の概略図
このように、欧州のSPC制度、データ保護期間、市場保護期間制度による全般的な保護の下で、医薬品の「実質保護期間」は短くとも10年となる。これに対して、中国のPTE制度の枠組みは、欧州のSPC制度に似ているものの、同様のデータ保護期間制度や市場保護期間制度は存在しない。具体的には、中国の「医薬品管理法実施条例」には、「新規な化学成分を含む医薬品の製造又は販売の許可を取得した製造者又は販売者が提出した未公開の試験データ及びその他のデータは保護される。何人も、その未公開の試験データ及びその他のデータを不正に使用してはならない。医薬品の製造者又は販売者が新規な化学成分を含む医薬品の製造又は販売の許可を取得した日から6年以内に、他の申請者が、許可を取得した申請の同意を得ずに、前項のデータを利用して新規な化学成分の医薬品の製造・販売の許可を申請する場合、医薬品監督管理部門は許可しない。ただし、他の申請者が自ら取得したデータを提出する場合はこの限りではない。」との規定はあるが、このようなデータ保護期間制度以外の市場保護期間制度はない。このように、現在、中国において、医薬品が享受できる「実質保護期間」は以下のとおりである。
● 結論 1 唐嘉偉ら.「中国医薬品の新時代~中米欧日の比較から見る特許法実施細則の改正による中国医薬品特許期間の延長制度PTEへの影響~」.『知産力』.2024.1.212 References: Study on the economic impact of supplementary protection certificates, pharmaceutical incentives and rewards in Europe, Copenhagen Economics, May 2018
共有ページ